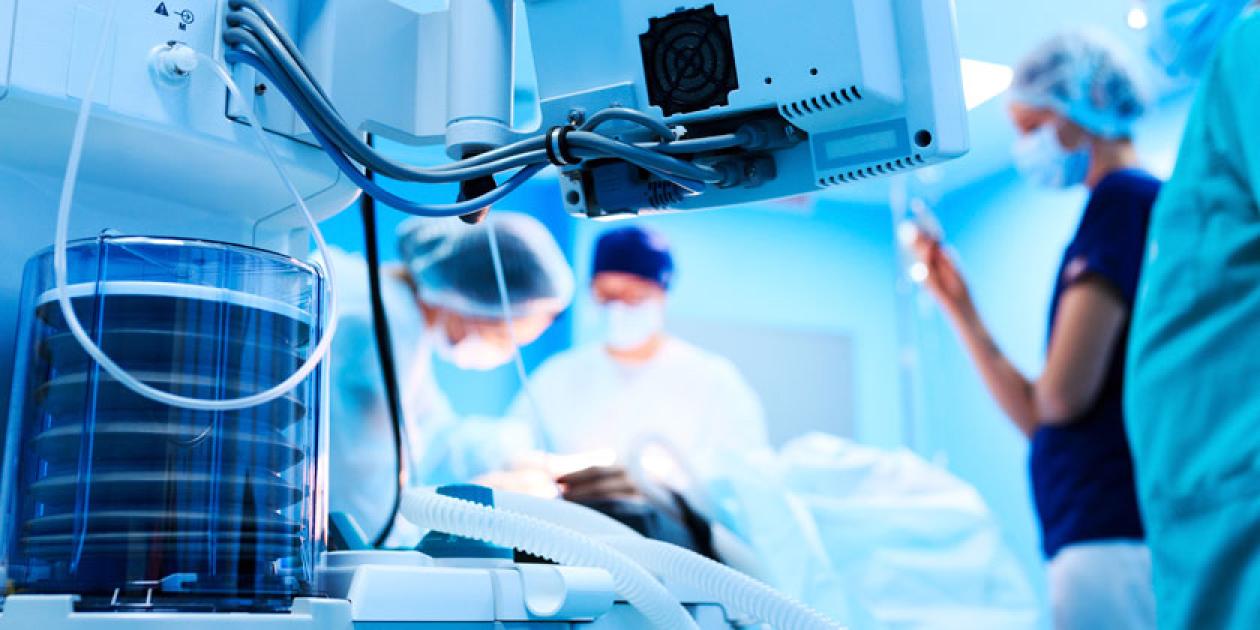
Filtración HEPA para patógenos transmisibles por aerosol en áreas críticas hospitalarias
La limitación de la carga biológica en el aire en forma de bioaerosoles en áreas hospitalarias singulares donde se ubican y tratan pacientes infectocontagiosos portadores de agentes biológicos aerotransportables, resulta crítica. La interposición de filtros HEPA como barreras biológicas de alta eficacia es el mecanismo de barrera estático para su control. Para garantizar un estatus óptimo en el mantenimiento de la aerobioseguridad, resulta fundamental su cualificación o comisionamiento tanto de inicio de actividad como de forma periódica, así como la evidencia verificable de los procesos de descontaminación previos a su retirada.
Bioaerosoles
William Firth Wells, entre 1934 y 1955, estudiando la forma de transmisión del agente biológico patógeno aerotransportable, mycobacterium tuberculosis, productor de la tuberculosis, estableció de manera generalista, dos tamaños de gotas dentro del mecanismo físico de la transmisión. Dividió las emisiones de gotitas respiratorias en gotitas "grandes" y "pequeñas".
En referencia al tamaño menor, los denominados núcleos de Wells o núcleos de gotitas, permanecen suspendidos en el aire durante largos espacios de tiempo manteniendo su condición infecciosa.
Trabajos recientes han demostrado que las emisiones de complejos goticulares generados en actos relacionados con las vías respiratorias inferiores, medias y superiores y que son implícitos a la vida y propios del ser humano, están formadas por gotas mucosalivales con trayectorias de emisión de corto alcance de tipo semibalístico de tipo aislado y por nubes de régimen turbulento multifase en alta humedad relativa y temperatura media, que agrupan gotas de diferentes tamaños. Son los denominados aerosoles. Constituye un error establecer una frontera de 5 µm entre gotas y aerosoles.
En USA, Los Center for Desease Control and prevention, CDC, en 1990 confundieron el tamaño de un patógeno, que puede penetrar en los pulmones llegando a los alvéolos (5 µm) e infectar (US EPA, 2020), con el patógeno que cae al suelo en 1-2 m (100 µm). En 2007 reconocieron el error (CDC, 2007), no así la OMS que ha mantenido la confusión hasta el año 2020 (WHO, 2020a).
El término bioaerosol se utiliza para describir partículas entre los 0.001µm - 100µm. Ya que solo una pequeña fracción son esféricas, las partículas irregulares se presentan con un diámetro equivalente. Actualmente, se encuentra claramente determinado que las gotículas balísticas se encuentran en tamaños entre las 100 µm a 1000 μm (Chen et al., 2020) cayendo al suelo a distancias entre 1 y 2 metros (Wells, 1934; Xie et al., 2007), mientras que un aerosol presenta un tamaño inferior a las 100 µm (Wells, 1934; Prather, 2020b).
Física del bioaerosol
Según la ley de Stokes, los bioaerosoles compuestos por partículas de 100 µm, presentan una vida media en suspensión de segundos, mientras que partículas con diámetros aerodinámicos de 10 µm, 3-1 µm y 0,5 µm, su vida media se corresponde con minutos, horas y días, respectivamente.
Además, las condiciones físicas y termohigrométricas ambientales en el punto donde se genera un aerosol, van a permitir su mantenimiento en suspensión en mayor o menor medida, evitando su rápida desecación.
Un parámetro adicional que profundiza en la potencia de las infecciones aerotransmitidas, se centra en las condiciones de viabilidad del virus en la atmósfera.
En 2011 y 2012, Yang et al., concluyen que la viabilidad del virus en un aerosol como medio de transporte se ve potenciado por el tanto por ciento de humedad relativa presente. Taylor and Tasi en 2018 concluyeron que humedades relativas inferiores al 40% posibilitan un incremento de la facilidad de supervivencia y por lo tanto de transmisibilidad por tres razones fundamentales:
- La desecación de las gotículas de gran tamaño.
- La resistencia a la desecación de determinados patógenos (Goffau et al. 2009; Stone et al. 2016) cuya supervivencia y viabilidad se incrementa en condiciones de baja humedad relativa.
- La debilitación de las barreras de las membranas mucosas y del sistema inmune (Kudo et al. 2019).
Sharfman et al., en 2016 y mediante fotografía de alta velocidad, demostraron procesos de fragmentación de distribución goticular en diferentes tamaños. Por otro lado, Asadi et al. (2019) descubrieron una alta varibilidad de individuos frente a la generación de número y tamaños de gotas al hablar.
En 2020, Anfinrud et al. (2020), verificaban esta situación y recientemente Bourouiba, centrándose en los factores de protección de las mascarillas autofiltrantes frente a SARS-COV-2, puediendo alcanzar distancias de 7-8 m mediante un estornudo.Basado en estos principios, Morawska y Cao (2020) destacaron que partículas virales contenidas en estas nubes pueden mantenerse y trasladarse a distancias de hasta 10 metros desde la fuente de emisión.
Ventilación
En ambiente interior, el riesgo de infección es 20 veces mayor que al aire libre (Nishiura et al., 2020; Qian et al., 2020), por lo que la ventilación natural o forzada se convierte en un factor extraordinariamente importante para el control de la trasmisión.
Pero de nuevo el tamaño de las gotas vehiculares de los patógenos aerotransmisibles es fundamental.
La ventilación por dilución y los diferenciales de presión atmosférica no interfieren de forma significativa en la transmisión aérea de las gotículas balísticas que caen con rapidez por gravedad y quedan retenidas en las superficies con mayor o menor afinidad. Pero sí es determinante en la propagación de los aerosoles, incluidas las gotículas de grandes dimensiones (100 μm) que reducen su tamaño en su proceso natural de desecación por evaporación, para convertirse en núcleos goticulares (Siegel et al. 2007).
Además, los sistemas de ventilación no eliminan la rápida caída de las gotículas grandes, pero crean flujos direccionales que permiten la movilización de los aerosoles.
Por otro lado, es conocido dentro de los estudios para una correcta ventilación de interiores que el aire exhalado está normalmente más caliente que el aire ambiente, y se eleva (Chen et al., 2020). Esto ayuda a la dispersión de los aerosoles al aire libre.
En interiores la dispersión está limitada por el techo, y eventualmente ese aire vuelve a bajar al mezclarse el aire en el local. En consecuencia, no es posible explicar la gran diferencia en contagio entre ambientes interiores y al aire libre si la transmisión estuviera dominada por gotículas balísticas.
En interiores se observa un aumento de la probabilidad de infección de COVID19 en espacios cerrados con poca ventilación (CDC, 2020a; WHO; 2020a). La ventilación tiene un gran impacto en reducir el nivel general de aerosoles en un espacio cerrado.
El peso específico de un sistema de ventilación forzada que favorecerá o dificultará la posibilidad aerotransmisibilidad y por lo tanto de infección, dependerá de los factores biológicos y físicos referenciados y de factores técnicos, como los de equipo, posición de sistema de ventilación en el espacio a ventilar, de la potencia que presenta, de la distribución del aerosol liberado, de la presurización positiva o subatmosférica diferencial de la sala (CDC 2005) y de la ventilación de captura de la fuente, entre otros.
Para poder seguir leyendo este artículo y poderlo descargar en PDF debe iniciar sesión o darse d alta en el portal.
Para poder escribir un comentario debe iniciar sesión o darse de alta en el portal.