Bioimpresión de tejidos y órganos: ¿nueva incorporación tecnológica en los hospitales?
Los avances científicos y tecnológicos en el ámbito de la salud abren un sinfín de nuevas posibilidades de prevención, diagnóstico y tratamiento. Con la validación tecnológica, llega la incorporación de estos avances a la práctica clínica. Como expertos en ingeniería de la tecnología médica, nos ocupamos de prever su incorporación y dimensionar el impacto las nuevas tecnologías en infraestructuras de salud, ya sea en forma de nuevos equipos como en espacios, circuitos, funcionalidades y/o requisitos de implantación.
En el contexto de la medicina regenerativa, llevamos tiempo oyendo hablar de las terapias avanzadas, terapias génicas y celulares, como las células CAR-T o las células madre, que ofrecen opciones de tratamiento a enfermedades que nos parecían incurables, ampliando día a día el abanico de aplicaciones. Una tercera tipología de estas terapias avanzadas es la ingeniería tisular y, especialmente, la bioimpresión. La bioimpresión –o bioimpresión 3D o 3D bioprinting– es una tecnología de fabricación aditiva que permite fabricar estructuras biológicas vivas capa por capa. Utilizando biotintas, mezclas de materiales compuestas por células, biomateriales y nutrientes, busca replicar la arquitectura y funcionalidad de los tejidos humanos. ¿El resultado esperado? A medio y largo plazo, la biofabricación a medida de tejidos y órganos personalizados y a demanda (bioimplantes), para uso en regeneración de tejidos y como sustitución del trasplante de órganos; a corto y medio plazo, la biofabricación de tejidos y órganos modelo (biomodelos) para uso en ensayos pre-clínicos, en sustitución de animales, en drug screening o en ensayos rutinarios de toxicidad y/o estudio farmacológicos o fisiológicos.
Si bien el término bioimpresión –bioprinting– lleva ya más de 35 años en uso, la tecnología se encuentra todavía en fase emergente, con grandes retos científicos todavía por solucionar, principalmente en lo relativo a la vascularización y la funcionalidad de las estructuras. El primer ensayo clínico de un producto de bioimpresión lo identificamos en 1999, cuando un grupo de investigadores del Boston Children’s Hospital creó, de hecho, a mano, la primera vejiga urinaria mediante la superposición de estructuras 3D y la siembra de células humanas. Pese al éxito alcanzado en la mayoría de pacientes del ensayo, no se adoptó la tecnología como práctica clínica. Desde entonces, científicos e ingenieros han diseñado un modelo de riñón multifuncional (2002), han creado el primer vaso sanguíneo bioimpreso (2009) y obtenido la primera bioimpresora comercializada (2009), y han desarrollado la primera oreja bioimpresa con detección auditiva (2014). Desde 2010, se multiplican las publicaciones y propuestas de bioimpresión de piel, hígado, válvulas y parches cardíacos, páncreas, y elementos vascularizados del sistema músculo-esquelético. Hoy en día, y desde 1999, tenemos contabilizados 29 ensayos clínicos a nivel mundial, no siempre completados, y ya sea de biomodelos o bioimplantes, pero únicamente 1 terapia aprobada a nivel mundial.
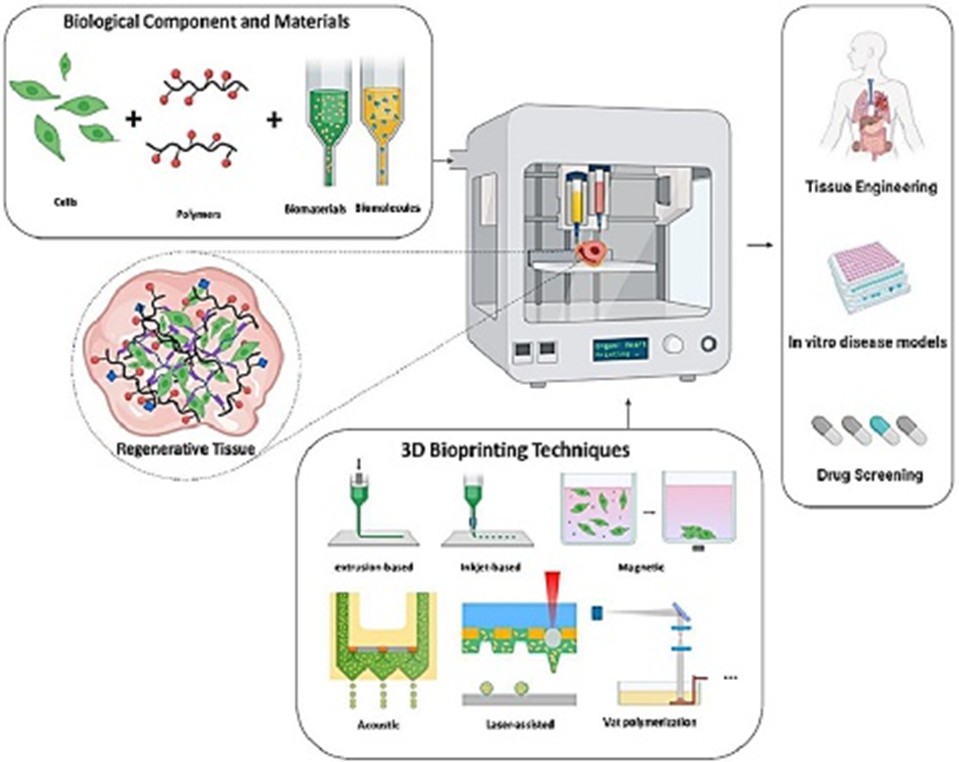
Esquema de funcionamiento de la bioimpresión. Fuente: HESAM University, Paris

Bioimpresora. Fuente: Cellink (Biko)
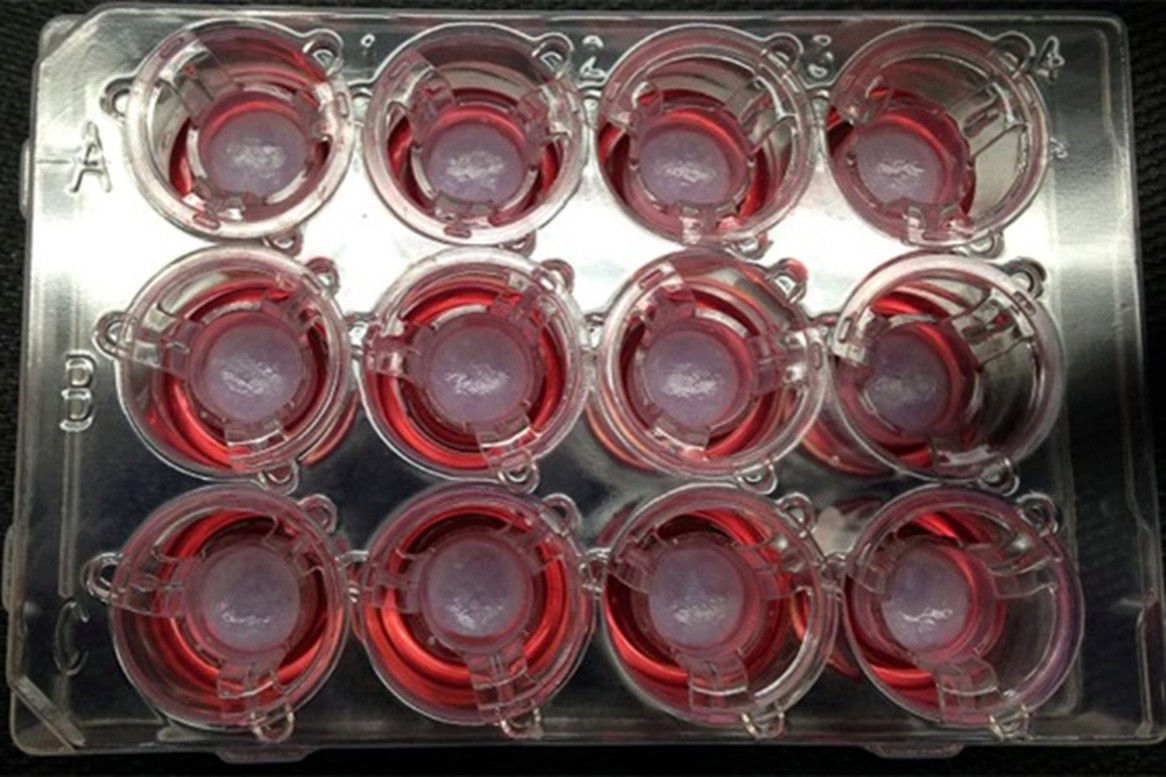
Tejidos bioimprimidos en placa. Fuente: US-National Center for Advancing Translational Services
INCORPORACIÓN A LA PRÁCTICA CLÍNICA
Actualmente, es ya habitual encontrar en institutos de investigación biomédica y en hospitales universitarios o de tercer nivel, laboratorios de impresión 3D, espacios dedicados al diseño e impresión de modelos y dispositivos médicos tales como órganos modelo para uso en formación y/o en planificación quirúrgica, elementos implantables, guías quirúrgicas a medida, o dispositivos no implantables personalizados. También es habitual encajar estos laboratorios de impresión 3D en un entorno de modelización 3D que va más allá de la impresión, y que incluye técnicas de simulación virtual de procesos e instalaciones, visualización 3D de imagen médica, o desarrollo de gemelos digitales entre otros.
Es de esperar que la impresión 3D abra la puerta a la incorporación de la bioimpresión 3D a la práctica clínica, si bien el tipo de producto y, sobre todo, los condicionantes legales y de producción, implican otro paradigma en las condiciones de la instalación de fabricación. Así, mientras los productos implantables fabricados mediante impresión 3D utilizan únicamente materiales biocompatibles o, a veces, incentivadores del desarrollo celular propio del paciente, y por ello se clasifican como dispositivos médicos, los productos de bioimpresión incluyen material vivo a base de células humanas y, por ello, se clasifican como medicamento, específicamente como medicamento de terapia avanzada. Las células pueden proceder de donante –y obtener productos alogénicos– o del propio paciente –y obtener productos autólogos– y deberán ser seleccionadas, a veces reprogramadas, quizás modificadas y siempre cultivadas o expandidas hasta obtener suficiente cantidad.
La diferencia de clasificación legal –dispositivo médico vs medicamento de terapia avanzada– conlleva diferencias a múltiples niveles: en el proceso de producción, en las condiciones y requisitos de fabricación, en los perfiles profesionales implicados, en los materiales utilizados, en las condiciones de almacenamiento y transporte, etc., lo que puede originar diferencias notables en el modelo productivo y de negocio (por no hablar de las diferencias en el nivel de desarrollo de la tecnología, ya establecida y en expansión en el primer caso, todavía emergente en el segundo).
¿Condicionará la incorporación de la bio impresión a la práctica clínica la arquitectura y tecnología de los hospitales? Por lo pronto, la producción de tejidos y órganos humanos como tratamiento de medicina regenerativa, considerado una terapia avanzada, requerirá de una instalación de sala blanca bajo normas de funcionamiento GMP. Allí donde se biofabriquen los implantes vivos, sea en el mismo hospital, en un laboratorio de investigación o en una instalación farmacéutica, deberán instalarse una o más salas blancas donde llevar a cabo las distintas etapas de la bio impresión -pre-bio impresión, bio impresión y post-bio impresión -, a similitud de lo que ya se hace para la bio fabricación de otras terapias avanzadas, celulares y/o génicas, que ya están en translación. La organización del proceso de biofabricación y la distribución de espacios, pero sobre todo la tecnología, el grado de automatización y la robotización, dictarán la capacidad productiva y las posibilidades de escalado de la producción, uno de los principales retos de la biofabricacion, siendo todavía mayor que en casos de terapias celulares y genéticas.
Un elemento de debate que condicionará la arquitectura de los hospitales en lo relativo a la disponibilidad de salas blancas para biofabricación es justamente la alternativa entre modelos de producción centralizada frente a los modelos descentralizados o de producción point-of-care (en el lugar de uso). En un modelo centralizado, la biofabricación de productos de bioimpresión –o de otras terapias avanzadas- se desarrolla en una instalación no hospitalaria, un laboratorio farmacéutico o biotecnológico, desde el que se trasladarán los bioimplantes hacia el lugar de uso –clínica u hospital–. A similitud de otros modelos de negocio farmacéuticos, la biofabricación centralizada inicia el ciclo en el hospital mediante la prescripción médica. Empieza a partir de aquí la etapa de diseño personalizado del implante y, en caso de soluciones autólogas, deberán obtenerse células del paciente, en el mismo hospital o en otro espacio que permita la toma de muestras adecuada, para enviarlas seguidamente a la instalación de biofabricación, donde se desarrollarán las etapas de pre-bioimpresión, bioimpresión y post-bioimpresión que mencionamos antes. El ciclo se cierra con el envío del producto, nada trivial, desde la instalación al punto de uso (implantación en el paciente).

Modelo 3D de una instalación GMP de biofabricación de terapias avanzadas. Fuente: Creatio, Barcelona.
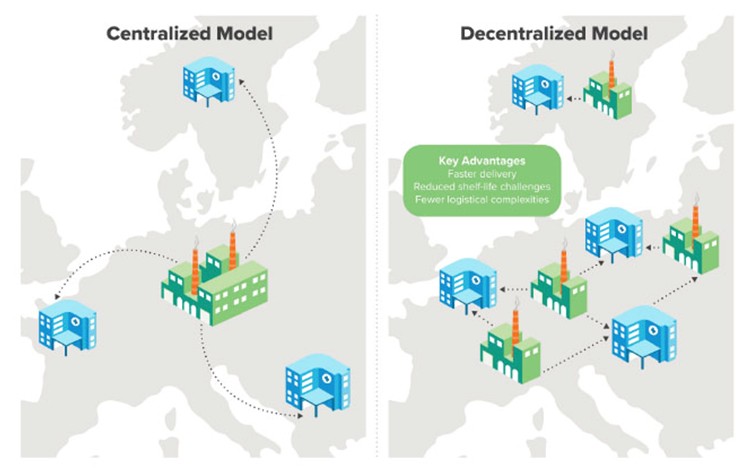
Esquema de modelo centralizado vs modelo descentralizado para la producción de terapias avanzadas. Fuente: International Society for Pharmaceutical Engineering (ISPE).
Para seguir leyendo este artículo debe iniciar sesión o darse de alta en el portal.
Para poder escribir un comentario debe iniciar sesión o darse de alta en el portal.