Normativa para planificación de equipo biomédico en América Latina: Colombia
Fecha: Abril 2018
Idioma: Castellano
Web: Ver aquí
Autora: Laia Solé, Ingeniera industrial, especialista en equipo biomédico. Biorem
Procedencia: D'Enginy Biorem
Cuarto capítulo de una serie de artículos que pretenden esclarecer cuestiones sobre la normativa de planificación de equipo biomédico para la homologación de establecimientos de salud en América latina. En este caso, la autora se detiene a explicar el caso de Colombia, después de habernos presentado los casos de Bolívia, Uruguay y Brasil en artículos anteriores. a
Capítulo 4: Normativa en la República de Colombia
a Para dar continuidad a la serie de normativa de planificación de equipo biomédico para homologación de establecimientos de salud en América latina en el presente documento se pretende analizar el estado de las publicaciones oficiales de la República de Colombia. Han sido objeto de nuestro estudio las normas que de alguna manera presentan y listan dotación de equipos biomédicos necesaria para dar funcionalidad a un establecimiento de salud, directrices para la homologación de planes de equipamiento. Recordamos en este punto que no son objeto de esta serie de artículos las normativas relativas a la legalización de los dispositivos médicos individuales que se usan en el territorio colombiano. Siguiendo estas directrices, toda la normativa publicada y disponible digitalmente a través de la web de INVIMA (Instituto Nacional de Vigilancia de Medicamentos y Alimentos) que hemos estudiado no está focalizada en el diseño u homologación de planes de equipamiento. Se centra en establecer reglamentos técnicos para garantizar medicamentos y alimentos disponibles en la nación libres de cualquier efecto nocivo.
La indagación ha concluido en la existencia de una única Resolución relativa a homologación de listas o planes de equipamiento para establecimientos de salud, aquí explicada, Resolución número 2003 de 2014 del Ministerio de Salud y protección. Es importante para ubicarse aclarar que no se trata de una normativa orientada a proporcionar un estándar y unos lineamientos de homologación del plan de equipamiento como tal, sino orientada a la habilitación de la totalidad de un Prestador de Servicios de Salud con todos los servicios que se deban incluir en el establecimiento de salud para poder abrir y ofrecer sus servicios. Parece lógico que el equipamiento biomédico esté sujeto a análisis para conceder un resultado satisfactorio sobre la habilitación del establecimiento y así es como nos será de interés. Como verán los ingenieros biomédicos que la consulten, y como se muestra en este artículo, no es una lista completa y exhaustiva, pero sí funciona como lista necesaria de equipos biomédicos que serán imprescindibles para cada una de las salas del establecimiento de salud a acreditar existentes en los circuitos funcionales de interés.
Es atribución del Ministerio de Salud y Protección Social de la República de Colombia regularizar mediante normas, estándares y lineamientos las características y funcionalidades mínimas y esenciales que deben poseer los Prestadores de Servicios de Salud del país. Se enmarca en crear habilitaciones para la entrada y permanencia de los centros de salud en el Sistema Obligatorio de Garantía de Calidad de la Atención de Salud. De este modo, se pretende ofrecer la seguridad a los pacientes de que los centros de salud pueden desarrollar al completo su cartera de servicios disponible y tener la certeza que lo hacen con excelente calidad. Fruto de la necesidad, este ejercicio de habilitación de Prestadores de Servicios de Salud se lleva a cabo mediante el seguimiento de la publicación oficial con título: “Manual de Inscripción de Prestadores y Habilitación de Servicios de Salud”.
Esta Resolución publicada por el Ministerio de Salud y Protección Social explica cómo se debe llevar a cabo el proceso, des de cuáles son los servicios de salud candidatos a las condiciones y criterios de verificación para la habilitación. El proceso empieza por una autoevaluación a realizar por el mismo centro prestador de salud. Si se supera este primer filtro se puede inscribir el centro en el Registro Especial de Prestadores de Servicios de Salud (REPS).
El organismo encargado de llevar a cabo la aplicación del Manual de Habilitación así como la gestión de documentación y logística necesaria será La Entidad Departamental o Distrital de Salud correspondiente. Esta procesa la inscripción con el objetivo de acordar una visita de verificación. Notar que si la habilitación corresponde a un nuevo servicio de oncología, la gestión del proceso como de documentación será por parte del Ministerio de Salud y Protección Social. Si el centro de salud funciona de acuerdo a lo establecido en el Manual, citado anteriormente, y supera satisfactoriamente el proceso de habilitación se validará su inscripción en el REPS y podrá ofertar y prestar la cartera de salud disponible de forma segura para todos los agentes implicados.
El objetivo global del REPS es llevar un control exhaustivo de cualquier alta, baja, suspensión o modificación. Así como controlar y programar visitas de habilitación periódicas para los Prestadores de Salud que ya están en marcha. Si bien hasta ahora se ha presentado los trámites del proceso de habilitación, el ingeniero biomédico tendrá interés en saber que el mayor grueso del Manual está destinado a la redacción de “Estándares y Criterios de Habilitación por servicio”. Condiciones mínimas relacionadas con la capacidad tecnológica y científica. Aproximadamente el 75% del documento se destina a definir las condiciones de capacidad tecnológica y científica, entre las cuales la lista de equipos biomédicos imprescindibles en cada espacio para obtener la homologación o habilitación del establecimiento. La norma estandariza una organización de los servicios de salud para homogenizar el registro en la REPS. Distingue grupos que hacen referencia al nivel de clasificación más amplio de los servicios de salud. El siguiente nivel de clasificación es el servicio como unidad básica objeto de la habilitación. Los servicios se reúnen en grupos, características de atención o etapa asistencial similares, ya que los criterios y estándares también serán similares. Se desglosan los siguientes grupos: protección específica y detección temprana, consulta externa, urgencias, apoyo diagnóstico y complementación terapéutica, internación, quirúrgicos, traslado de pacientes y otros servicios como atención domiciliaria. A nivel de los servicios, la norma define los criterios de habilitación según diversos estándares que incluyen el talento humano; infraestructura; dotación; medicamentos, dispositivos médicos e insumos; procesos prioritarios; historia clínica y registros e interdependencia. 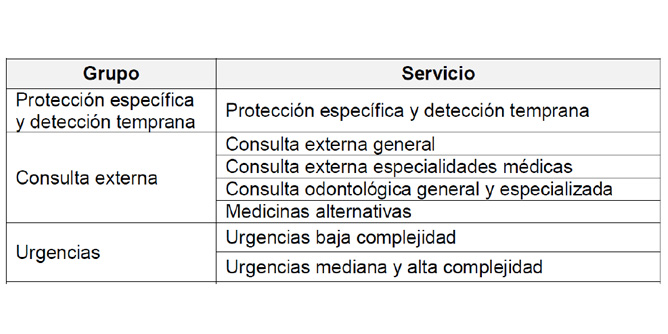
Tabla 1. Muestra parcial de la tabla 1 de la Resolución número 2003 de 2014: Estructura de los servicios de salud. Fuente: Resolución número 2003 de 2014.
[visitante]Para seguir leyendo el artículo debe iniciar sesión o darse de alta en el portal[/visitante]
Para poder escribir un comentario debe iniciar sesión o darse de alta en el portal.