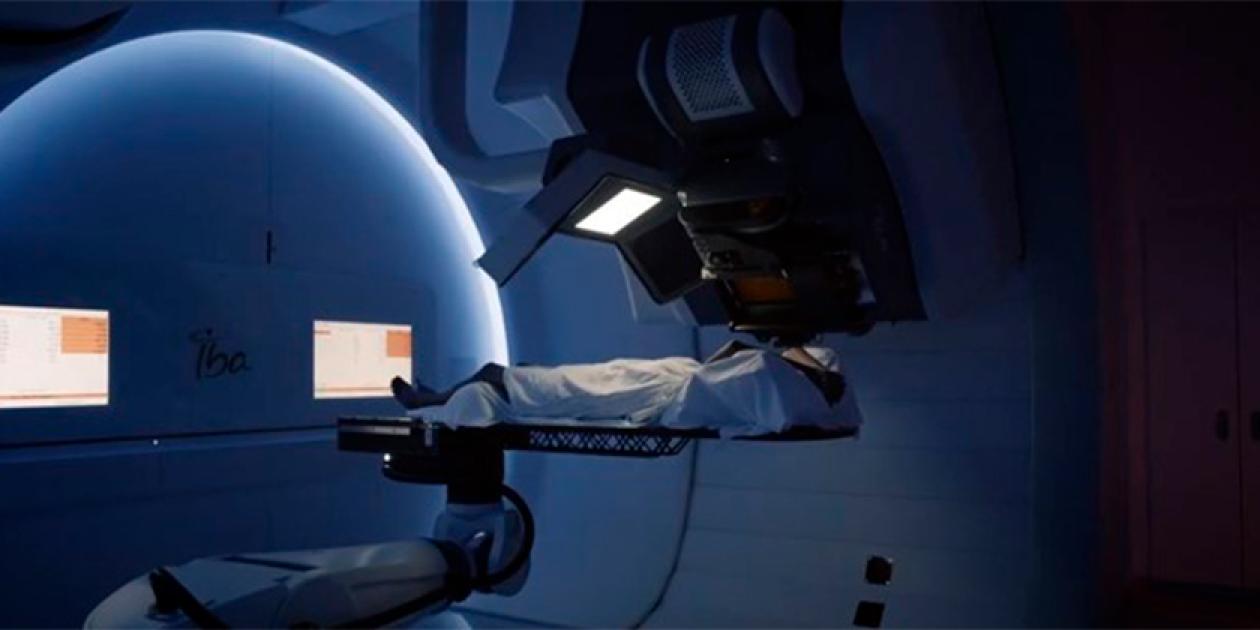
La Protonterapia, vista desde el interior
¿Qué es la protonterapia?
Es un tratamiento de radiación muy preciso que se enfoca más en el tumor y dirige menos radiación al tejido sano cercano.
La terapia de protones o protonterapia, en lugar de usar rayos X (fotones y electrones), como la radioterapia, emplea protones. Son empleados para enviar haces (rayos) de alta energía. Aunque no existe una diferencia significativa en los efectos biológicos de los protones frente a los fotones, sí lo hay en la manera de cómo actúan.
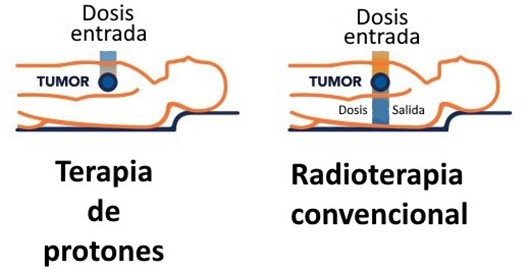
En la radioterapia tradicional, los fotones, también llamados rayos X, viajan a través del cuerpo y liberan energía que mata el cáncer a medida que avanzan. Como resultado, la radiación de rayos X tiene una dosis de entrada y de salida, lo que daña los tejidos sanos que rodean el tumor.
Los protones, naturalmente se mueven y liberan energía de manera diferente, lo que les permite viajar de manera segura a través del cuerpo, liberando una ráfaga de energía al final de su camino. La radiación de haz de protones se adapta a la forma específica del tumor, preservando el tejido sano y reduciendo el riesgo de efectos secundarios.
Pero antes de entrar en materia, repasemos un poco de historia.
Historia
Robert R Wilson (diseñador del laboratorio ciclotronico de la universidad de Harvard, HCL), en 1946, propuso por primera vez el uso de la energía protónica como un método de tratamiento efectivo. Los primeros tratamientos fueron efectuados con aceleradores de partículas construidos para investigación física, particularmente en el laboratorio de radiación de Berkeley en 1954 y en Uppsala en Suecia en 1957. En 1961, inicia una colaboración entre HCL y el hospital general Massachusetts (MGH). Tenían el fin de ejercer la terapia protónica. Durante los próximos 41 años, este programa reforzó y expandió dicha técnica. Mientras, se trataban a 9.116 pacientes antes de que el ciclotrón fuera cerrado en 2002.

Centros de terapia protónica
El primer centro de terapia protónica en Europa occidental ha operado en el instituto Paul Scherrer (PSI) en Villigen, Suiza, desde 1984. En 1990 fue construido el centro médico universitario Loma Linda (LLUMC) en Loma Linda. Posteriormente, el centro de terapia protónica Nororiental en el hospital general Massachusetts fue comprado en línea. El programa de tratamiento HCL fue transferido a este durante 2001 y 2002.
Desde la década de los años 50, el uso de la protonterapia ha crecido de manera significativa. Durante los últimos años, y gracias al aumento de centros que disponen de esta tecnología. Hasta ahora, este tratamiento radioterápico está accesible en 27 centros en EE.UU. y en 20 en toda Europa (en países como Alemania, Francia o Italia y ahora España, entre otros).
Ciclotrón
Un ciclotrón es un tipo de acelerador de partículas cargadas, que combina la acción de un campo eléctrico alterno, y que les proporciona sucesivos impulsos, con un campo magnético uniforme que curva su trayectoria, que las redirige una y otra vez, hacia el campo eléctrico.

M. Stanley Livingston (izquierda) y Ernest O. Lawrence (derecha) hacia 1934 junto al ciclotrón de 69 cm (27 pulgadas) de diámetro en el antiguo Radiation Laboratory de la Universidad de California, Berkeley.
Fue inventado en el año 1934 por los físicos estadounidenses Livingston (1905-1986) y Lawrence (1901-1958) pero no se patentó hasta 1934 (por este motivo, este último recibió en 1939 el premio Nobel).
El ciclotrón consta de dos cámaras metálicas huecas con forma de semicírculo (se llaman “des”, D, a causa de su forma), ligeramente separadas dentro de un campo magnético B perpendicular. En las partes D1 y D2 se le aplica un voltaje de corriente alterna para que se produzca un campo eléctrico, entre el espacio que separe las D.
Supongamos un ion positivo, producido por una fuente de iones, tiene carga eléctrica q y masa m.
El campo eléctrico entre las dos D acelera el ion. Mientras el ion, está dentro de las D, no hay campo eléctrico. El ion describe una trayectoria circular de radio r debida a la acción del campo magnético B. La ecuación que relaciona estos parámetros es: r = mv/qB, donde v es la velocidad del ion. Cuando el ion va a salir de D1, el campo eléctrico cambia de sentido de tal manera que el ion se acelera de nuevo y entra en D2 con mayor velocidad, describiendo un semicírculo de radio mayor y así sucesivamente. Finalmente, el ion describe una espiral y cuando llega al borde externo de las D, una placa con un voltaje negativo se usa para extraer los iones del acelerador.
El campo magnético es un elemento auxiliar que obliga a los iones a describir trayectorias circulares. A esa velocidad recorren otra semicircunferencia de radio mayor que la primera y vuelven a acceder a la zona, entre las “des” donde se les aplica de nuevo el campo eléctrico (ahora en sentido contrario al anterior), que las vuelve a acelerar.
El proceso se repite una y otra vez hasta que las partículas salen finalmente del ciclotrón a una velocidad muy elevada, tras haber realizado en el interior del orden de 50 a 100 revoluciones. Capaces de transferir a las partículas una energía suficiente como para provocar la desintegración de núcleos atómicos.
Para explicar el funcionamiento de un acelerador como el ciclotrón, se hace referencia al esquema de las figuras 3a y 3b.
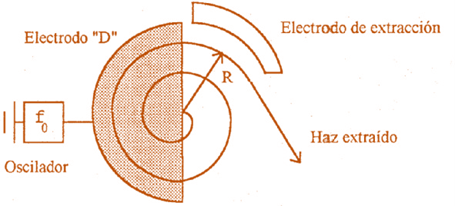
Figura 3a. Diagrama esquemático de las principales componentes de un ciclotrón.
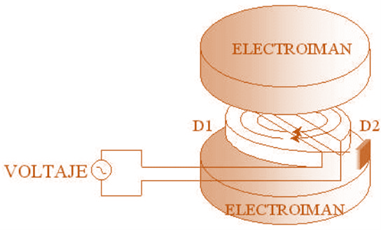
Figura 3b. Diagrama esquemático de un acelerador tipo ciclotrón.
La investigación realizada con ciclotrones adquirió especial relevancia durante la Segunda Guerra Mundial, en particular a partir de los trabajos de bombardeo de uranio (238U) con deuterones, lo que generaba núcleos de neptunio (238Np) y a su vez por desintegración beta núcleos de plutonio (238Pu). La detección de este isótopo del plutonio supuso, precisamente, el descubrimiento de este elemento químico. Un descubrimiento que se mantuvo inicialmente en secreto puesto que resultaba un elemento crucial (en especial el 239Pu) para la producción de armas nucleares. Al mismo tiempo, los ciclotrones fueron empleados también como espectrómetros de masas para facilitar la separación de isótopos de 235U y 238U y avanzar así en la posibilidad de construir, las tan ansiadas bombas.
Desde un primer momento se exploró la posibilidad de utilizar ciclotrones con fines médicos. Entre otras cosas, porque las posibles aplicaciones médicas, aumentaban las opciones de obtener la financiación necesaria con la que seguir desarrollando las investigaciones. Con ese objetivo, Ernest Lawrence convenció a su hermano John H. Lawrence (1904–1991), médico de formación, para utilizar el ciclotrón de 152 cm de diámetro. Las partículas de alta energía que generaba este aparato podían producir materiales radiactivos, radioisótopos, que trataron de emplearse con fines terapéuticos. De hecho, se tiene constancia de que se utilizó un isótopo de fósforo (32P) para tratar a pacientes de leucemia y se exploró la posibilidad de emplear neutrones para tratar el cáncer y crear marcadores para diagnósticos.
Principios
Los haces de protones, además de tener la capacidad de penetrar a una profundidad mayor y, por tanto, de alcanzar zonas y órganos más profundos, se paran, en lugar de continuar a través del cuerpo. Esto aporta una dosis proporcionalmente más alta en el tumor, pero relativamente menor en los tejidos cercanos sanos. En la radioterapia regular, el haz de energía entra en el cuerpo, atraviesa el tumor y continúa por el otro lado. Esta “dosis de salida” de radiación puede afectar al tejido sano más allá del tumor.
Según la Sociedad Estadounidense de Oncología Médica, se puede administrar hasta un 60% menos de radiación a los tejidos sanos con haces de protones. Esto permite una dosis más alta para el tumor y, en consecuencia, una mejora en la calidad de vida postratamiento.
La protonterapia es una forma de tratamiento de radiación que se usa para destruir las células tumorales. Una de sus grandes bazas es que reduce de forma significativa tratamientos innecesarios en tejidos sanos. Incluso se presenta como una fórmula eficaz para acabar con tumores en los que la radioterapia no resulta efectiva y la cirugía no es una opción.

Casos indicados
En términos generales, La Sociedad Americana de Oncología Radioterápica (ASTRO) justifica la aplicación de la protonterapia en los tumores de difícil acceso o que están rodeados de estructuras vitales. No obstante, enumera algunos en los que está especialmente indicada:
- Tumores primarios o metastásicos en la médula espinal/columna vertebral.
- Población pediátrica con tumores.
- Tumores oculares.
- Tumores cercanos o en la base del cráneo.
- Pacientes con síndromes genéticos con riesgo elevado de toxicidad.
- Re-irradiación en los casos necesarios.
En todos estos casos es especialmente importante que la dosis se pueda ajustar mucho más al tumor. De tal forma que se pueda administrar una dosis aún mayor mientras minimiza los efectos secundarios no deseados.
Para poder seguir leyendo este artículo debe iniciar sesión o darse de alta en el portal.
Para poder escribir un comentario debe iniciar sesión o darse de alta en el portal.